Fast alle Stadien des Prostatakarzinoms zeigen eine starke Abhängigkeit von Androgenen, den männlichen Geschlechtshormonen. Androgene wie Testosteron und Dihydrotestosteron vermitteln ihre Signale über den Androgenrezeptor (AR), ein Protein aus der Familie der Kernrezeptoren. Daher stellt die Hemmung der Androgen-/AR-vermittelten Signale einen zentralen Aspekt endokriner (hormoneller) Therapiekonzepte dar. Leider sind endokrine Therapien bisher nicht in der Lage, das Tumorwachstum dauerhaft zu unterdrücken und somit kommt es fast unweigerlich zur Tumorprogression mit der Bildung sogenannter kastrationsresistenter Zellen. Letztere sind in der Lage, trotz niedriger Androgenspiegel bzw. der Gabe von Anti-Androgenen auch weiterhin zu überleben und zu wachsen.
Ein kürzlich entdeckter Mechanismus, welcher es den Prostatakrebszellen ermöglicht endokrinen Therapien zu entgehen, ist die Synthese von verkürzten AR-Varianten (AR-V) denen die sogenannte Androgen-Bindungsdomäne fehlt. Trotz fehlender Androgenbindung sind AR-Vs, im Gegensatz zum „normalen“ AR, in der Lage Tumorwachstum und -progression auch in Abwesenheit androgener Stimuli zu gewährleisten. AR-Vs können auch nicht durch Anti-Androgene gehemmt werden. Sie entstehen durch alternatives Spleißen, einem molekularbiologischen Mechanismus welcher es den Zellen erlaubt, unterschiedliche Proteinvarianten aus einem Gen zu bilden. Dies garantiert den Zellen in weiterer Folge eine bessere Anpassung an veränderte Lebensbedingungen. In einigen Prostatakarzinomen führt die Aktivierung des alternativen Spleißens dazu, dass neben dem “normalen” AR auch eine konstitutiv aktive AR-Variante, AR-V7 exprimiert wird. Diese Expression führt in weiterer Folge zu einer dramatischen Abnahme bei der Wirksamkeit endokriner Therapien.
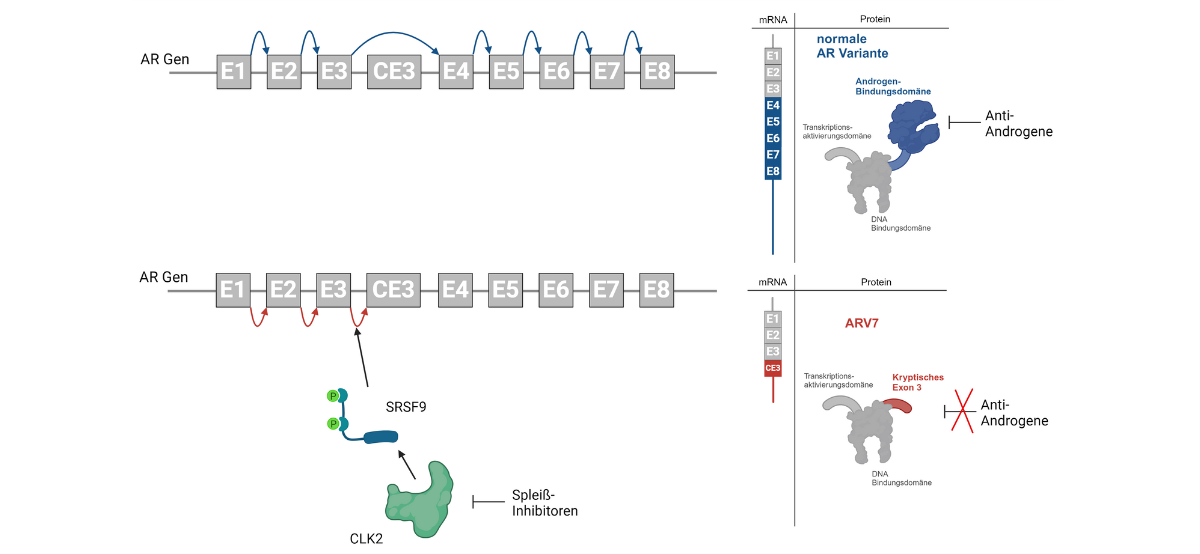
In einer Studie, die am 11. September 2024 in Molecular Oncology, der Partnerzeitschrift der European Association for Cancer Research, veröffentlich wurde, konnte eine internationale Forschergruppe (Leitung Frédéric Santer, Univ.-Klinik für Urologie, Medizinische Universität Innsbruck in Zusammenarbeit mit Marcus Cronauer, Institut für Pathologie, Universitätsklinikum Bonn) alternative Spleißfaktoren, die der AR-V7 Bildung zugrunde liegen, identifizieren. Des Weiteren konnte nachgewiesen werden, dass sogenannte Spleißinhibitoren zu einer Reduktion der AR-V7-Expression und einer Hemmung des Wachstums von Prostatakrebszellen führen. Somit könnten diese Substanzen eine vielversprechende neue Medikamentenklasse für die Behandlung des Prostatakarzinoms darstellen.
Das Forschungsprojekt wird mit einem Gesamtbetrag von 404.914 € unterstützt.
„Dank der Unterstützung der Spender der Fondation Cancer konnten wir einen molekularen Mechanismus beim kastrationsresistenten Prostatakrebs entschlüsseln und den Grundstein für eine mögliche neue Therapieoption legen.“
Dr. Frédéric Santer
Was Sie auch interessieren könnte


